2018年11月26日,FDA批准批Vitrakvi(larotrectinib)(代号LOXO-101)震撼上市,Vitrakvi(larotrectinib)是一种口服选择性原肌球蛋白受体激酶(TRK)抑制剂,用于治疗携带NTRK融合蛋白的实体瘤。Larotrectinib(LOXO101)今年11月份在世界惊艳亮相, 这款针对17种肿瘤有效的新药终于和广大癌症患者见面了! 同时,这款药物也有了自己的大名Vitrakvi。
可以说,从2016年12月18日,Loxo Oncology 公司的TRK抑制剂LVitrakvi(larotrectinib)(代号LOXO-101)初次在ESMO大会亚洲一期试验中展示对TRK融合肿瘤显示的持久抗肿瘤活性,就震惊了肿瘤界,这款不分癌症种类的广谱抗癌药开启了肿瘤治疗的新篇章,具有划时代的意义。
这一药物的批准,是癌症疗法从“基于癌症在体内的起源”转向“基于肿瘤的遗传特征”这一演变过程中的重要里程碑。
我们来回顾一下这款“神药”从研发到上市的光辉历程:
2015年9月:授予孤儿药物资格,用于携带NTRK融合蛋白的实体瘤2016年6月:婴儿纤维肉瘤罕见的儿科疾病指定2016年7月:突破性治疗指定“用于治疗不能切除或转移的实体肿瘤,其中NTRK融合蛋白用于需要全身治疗的成人和儿科患者,并且在先前治疗后进展或者没有可接受的替代治疗。2016年12月18日Loxo Oncology TRK抑制剂Larotrectinib(LOXO-101)在ESMO亚洲第1阶段更新中显示穿越TRK融合癌的持久抗肿瘤活性;2017年2月21日Loxo Oncology宣布完成Larotrectinib NDA主要疗效分析的临床试验注册;2017年5月12日FDA宣布授予Larotrectinib孤儿药物称号,指定用于治疗NTRK融合蛋白的实体肿瘤;2017年6月3日Loxo Oncology突破疗法Larotrectinib在美国临床肿瘤学会提交的TRK融合成人和儿童癌症中显示76%客观反应率!2017年12月12日Loxo Oncology更新Larotrectinib儿童临床试验数据显示TRK融合的持续耐受性;2017年12月20日Loxo Oncology开始向美国食品和药物管理局提交Larotrectinib新药申请用于治疗TRK融合肿瘤;2018年5月:FDA批准用于治疗患有NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者的优先审查。2018年11月26号正式在美国上市2018年2月21日Loxo Oncology宣布在新英格兰医学杂志上发表Vitrakvi(larotrectinib)临床数据:权威发布!针对17种肿瘤的传奇抗癌药LOXO-101最新研究数据公布!有效率75%!
其中有一些晚期患者的病灶完全消失了:
我们可以清楚的看到,这位极晚期的肉瘤患者,肿瘤已经快要填满双肺,经过LOXO-101治疗12周期,肿瘤几乎完全消失!
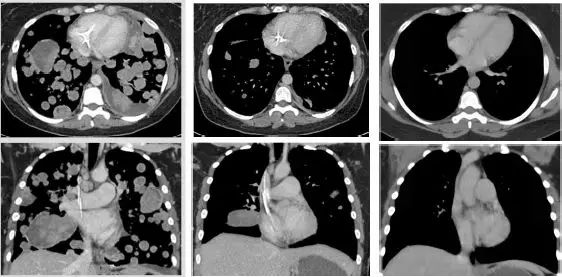
治疗前 治疗3周期第1天 治疗13周期第1天
2018年3月26日Loxo Oncology完成Larotrectinib治疗TRK融合癌新药申请滚动提交;
2018年3月28日在线的权威肿瘤学杂志柳叶刀上公布了传奇抗癌药larotrectinib(LOXO-101)的最新研究数据!该药在部分儿童癌症患者达到了93%的治疗应答!重磅新数据!针对17种肿瘤的传奇抗癌药LOXO-101公布新数据,这次有效率高达93%!
2016年,13岁的的Briana Ayala,被发现在她的腹部有一个罕见的肿瘤,包裹在她的主动脉周围。Briana参加了larotrectinib的1期临床试验,几周之内,她的腹部疼痛和肿胀消失,扫描显示她的肿瘤显着缩小。将近两年后,Briana重返学校!
德克萨斯大学西南分校的研究人员表示,larotrectinib在1期临床试验中93%的儿科患者有效。(照片由比尔布兰森/国家癌症研究所提供)

2018年5月29日FDA接受Larotrectinib新药申请并授予优先审查;
2018年10月21日Larotrectinib在109个TRK融合癌症患者的扩展数据显示81%的总体反应率;权威公布!“治愈系”抗癌明星药LOXO-101新数据:有效率81%!下个月上市(附PDF)
此次批准是基于larotrectinib在多项临床试验中的表现。根据今年10月在欧洲肿瘤内科学会(ESMO)年会上公布的最新数据,在55名可以用RECIST标准衡量的TRK融合癌患者中,larotrectinib能够达到80%的客观缓解率(ORR)。值得注意的是,larotrectinib在多种癌症类型中的表现都非常一致。
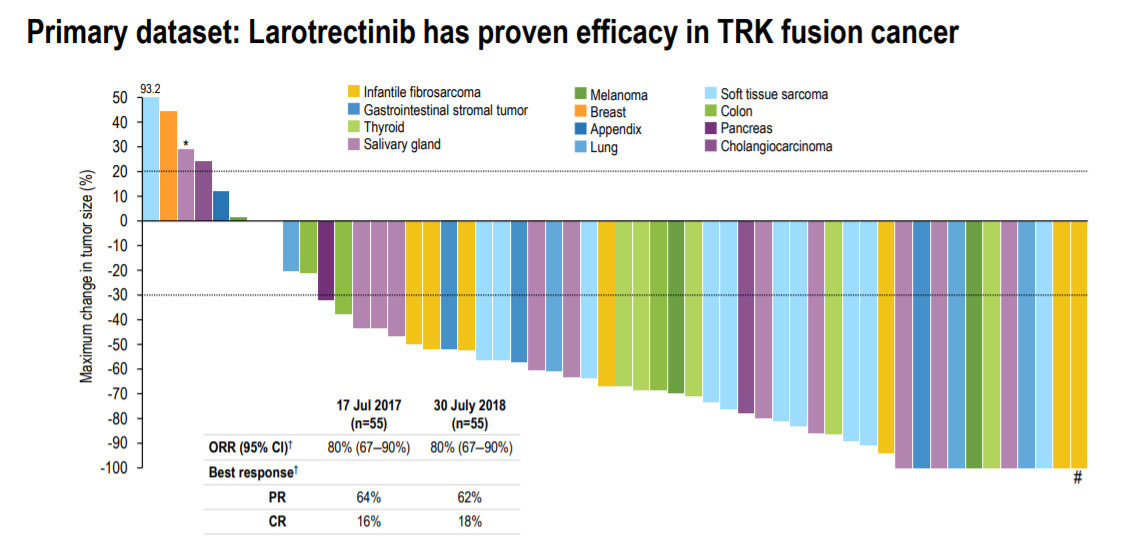
▲Larotrectinib在多种肿瘤类型中都有一致的有效性(图片来源:Loxo Oncology官网)
这是FDA第二次批准基于不同类型肿瘤的常见生物标志物的癌症治疗,而不是肿瘤起源的身体部位。PD-1的获批和TRK抑制剂的成功,为不区分肿瘤来源广谱抗癌药物快速发展奠定了基础,让梦想照进现实!
关于LOXO-101一定要了解的八个问题!
一、哪些患者可以使用Vitrakvi(larotrectinib)?
这个靶向药不仅疗效显著,还是广谱抗癌药物,对很多不同肿瘤都有效!这也这个药品这么吸引眼球的原因。
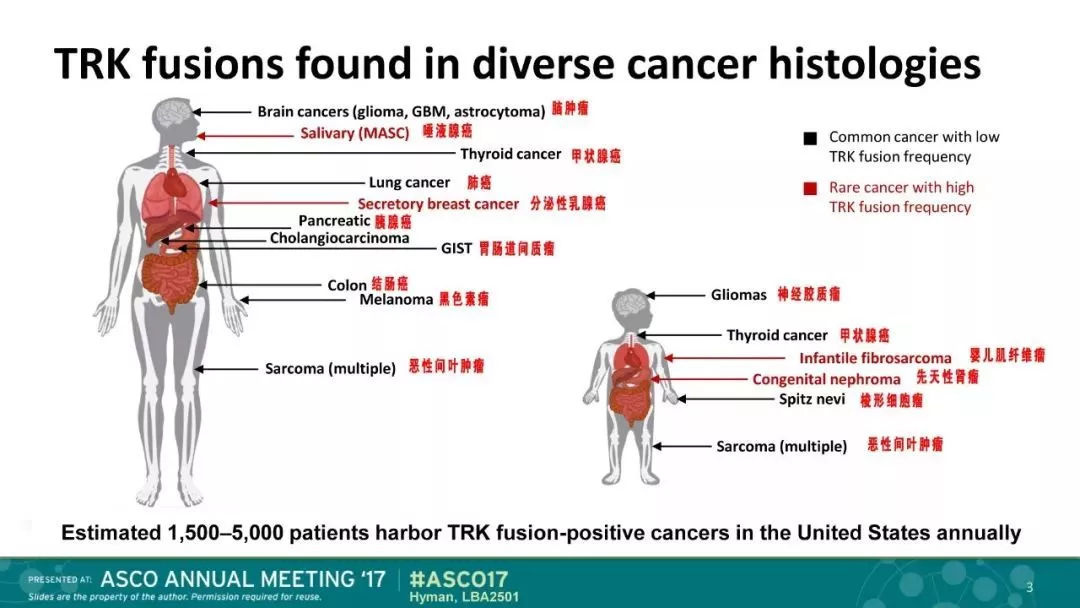
在实验中,这些患者肿瘤类型包括10种不同的软组织肉瘤,唾液腺癌,婴儿纤维肉瘤,甲状腺,肺,黑素瘤,结肠,胃肠道间质瘤(GIST),乳腺癌,骨肉瘤,胆管癌,原发性未知癌,先天性中胚层肾癌,阑尾和胰腺癌。
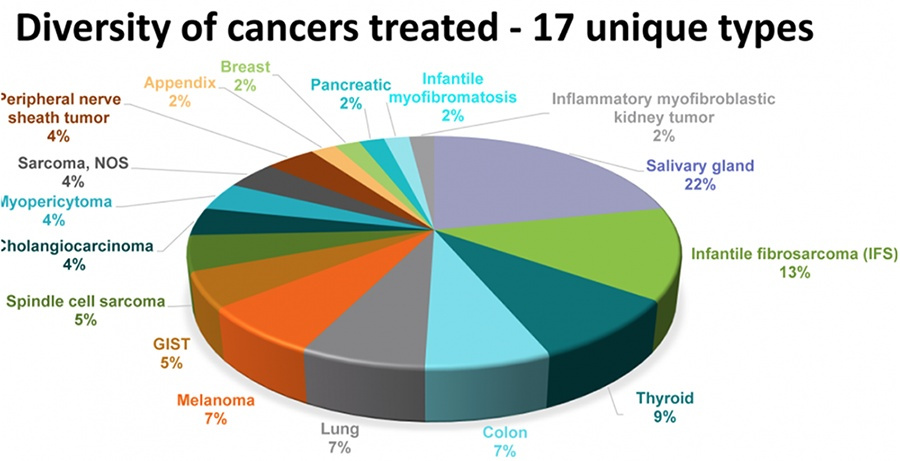
PD1免疫药物被批准用于MSI-H分子类型的各种肿瘤,成为第一个“广谱免疫药物”。LOXO-101很有可能后来者居上,应该会是第一个上市的“广谱靶向药物”。
因此,只要你经过基因检测,存在NTRK1、NTRK2或者NTRK3基因融合,理论上都是适合的!
二、如何检测NTRK基因?
NTRK基因包含NTRK1、NTRK2和NTRK3,分别负责编码原肌凝蛋白受体激酶(TRK)家庭蛋白TRKA TRKB和TRKC的合成。神经营养因子与TRK蛋白质结合后可诱导受体二聚体化、磷酸化并激活下游PI3K、RAS / MAPK / ERK和PLC-γ的信号级联通路。越来越多的研究表明,TRK信号通路的改变,包括基因融合、蛋白过度表达或单核苷酸改变,已经被发现是许多肿瘤的致病原因,特别是NTRK基因的融合,是目前其中最明确的致癌原因。
只有敏感和特异的检测才能可靠地检测出TRK融合癌基因。 新一代测序(NGS)可以提供大量基因的基因组改变的全面视图,全基因检测可以较准确的显示有无NTRK基因融合。荧光原位杂交(FISH)也可用于检测TRK融合癌,免疫组化(IHC)可用于检测TRK蛋白的存在。
做过癌症基因组检测的晚期癌症患者可能会发现他们的肿瘤存在TRK融合,因为这种基因组事件已在许多肿瘤类型中被描述,包括:
急性髓性白血病星形细胞瘤脑低级别胶质瘤乳腺癌结直肠癌先天性中胚层肾瘤胃肠道间质瘤多形性胶质母细胞瘤头颈部鳞状细胞癌肝内胆管细胞癌肺癌唾液腺来源的乳腺类似物分泌癌黑色素瘤肉瘤分泌性乳腺癌甲状腺癌一般检查融合基因需要使用二代基因检测技术。而且一定注意是NTRK基因与其他基因融合发生的突变,而不是一个随便的点突变。
三、你需要了解的NTRK基因知识
NTRK基因包含NTRK1、NTRK2和NTRK3,分别负责编码原肌凝蛋白受体激酶(TRK)家庭蛋白TRKA TRKB和TRKC的合成。
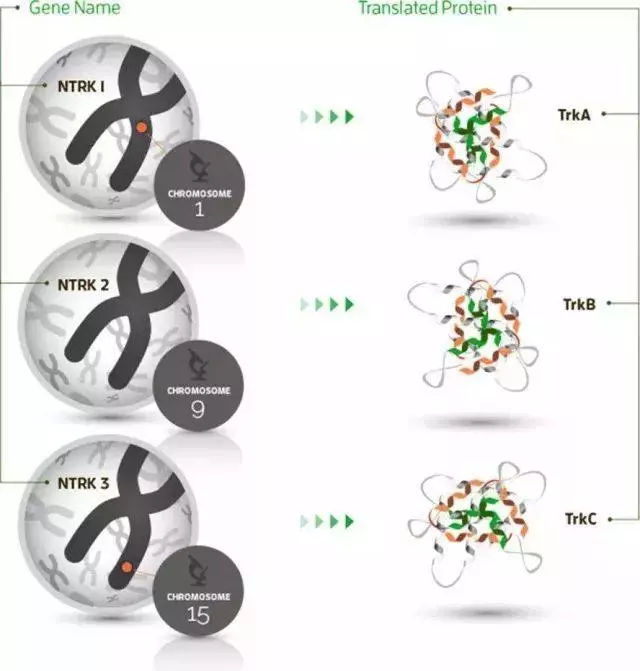
上面是NTRK基因家族,包含NTRK1、NTRK2和NTRK3,这个基因如果和其他的基因发生了融合突变,那么就导致了异常的活性,驱动了肿瘤的发生。
NTRK在多种肿瘤中都有发现,虽然在常见肿瘤肺癌、结直肠癌中的发病率低于5%,但该通路在各癌种致病中共享。larotrectinib是治疗TRK基因突变癌症患者的第一选择。
四、Vitrakvi(larotrectinib)耐药后怎么办?
面对任何靶向药物,总会出现的一个问题是:会不会出现耐药现象?
很不幸,多数患者会,因为肿瘤细胞也在不断进化。
事实上,已经有一些参与LOXO-101临床试验的患者出现了耐药。
面对耐药现象,目前只能把希望寄托在是新一代靶向药物。
可喜的是,现在靶向药物开发很早期,就会考虑耐药问题和解决方案。很多时候一代药物还没上市,二代药物就准备好了。科学家经过研究,发现LOXO-101耐药机理和EGFR情况很像,主要是靶点本身(TRK基因)产生了新的突变,比如TRKA出现G595R突变,或者TRKC出现G623R突变。
2017年11月,拜耳与Loxo肿瘤学开展了一项独家全球合作,开发LOXO-195,一种新型TRK抑制剂,也是第二代TRK靶向药物LOXO-195已经出炉。拜耳和Loxo Oncology将共同开发这种产品,专门来对抗LOXO-101耐药新突变。
关于第二代TRK靶向药物的论文也在2018年初发表,最初的两位耐药患者尝试新药后,肿瘤再次快速缩小。比如下面这位,用药一个月后,耐药的肿瘤就再次几乎消失!
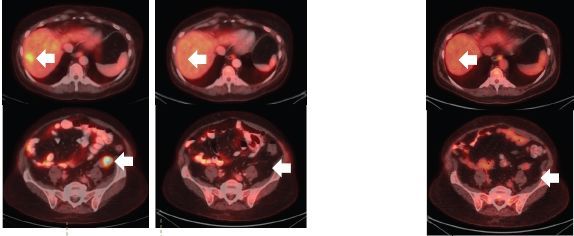
耐药后 使用2代药一个月后
LOXO-195上个月已经被FDA批准正式开展临床试验,耐药患者有了新希望。
五、Vitrakvi(larotrectinib)副作用有哪些?
对于肿瘤药物,一个大家很关注的问题是:毒副作用严重么?
药物的安全性和有效性同样重要,患者的生活质量和生存时间同样重要。
LOXO-101展现的疗效固然惊艳,但对于熟悉TRK基因,甚至开发过类似药物的科学家,这个药在临床展现出来的副作用十分轻微,这也给大家吃了一个定心丸。
Vitrakvi(larotrectinib)表现出来的副作用十分轻微,主要包括:
大多数患者(93%)发生1级或2级不良反应(AE)。没有治疗相关4级AE,最常见的治疗相关3级AE包括:ALT或AST上升(5%),贫血(2%),中性粒细胞计数减少(2%),恶心(2%)和头晕(2%)。
无论归因如何,最常见的3级AE(≥5%)为贫血(11%),ALT或AST升高(7%),中性粒细胞计数减少(7%)和体重增加(7%)。
这很可能不是纯粹的运气,因在开发LOXO-101过程中,科学家就针对性地做了大量优化,希望保持对肿瘤疗效的同时,减少对神经的毒副作用。比如,他们让LOXO-101通过血脑屏障的能力减弱,这样对大脑影响小一些。
到底是优化起了主要作用,还是人和动物模型有本质区别,现在很难说清楚。
重要的是,现在LOXO-101看起来是个有效而且安全的好药!
六、如何使用Vitrakvi(larotrectinib)?剂量和方法
FDA首次批准日期:2018年11月26日
品牌名称:Vitrakvi
通用名称:larotrectinib
剂型:胶囊和口服液
公司:Loxo Oncology,Inc。
治疗:TRK融合癌症
LOXO-101:实验中有液体和胶囊规格和形式; 25mg和100mg胶囊也可供儿科患者使用。
剂量:成年人:Larotrectinib对成年人的剂量是100mg,每天两次!;儿童按年龄和体重使用剂量。
七、国内患者如何接受Vitrakvi(larotrectinib)治疗
由于这款“抗癌神药”刚刚在美国上市,所以目前市场很难买到,不过Medtrip公司的工作人员已经跟美国药厂联系,会第一时间公布药品的价格和市场信息!
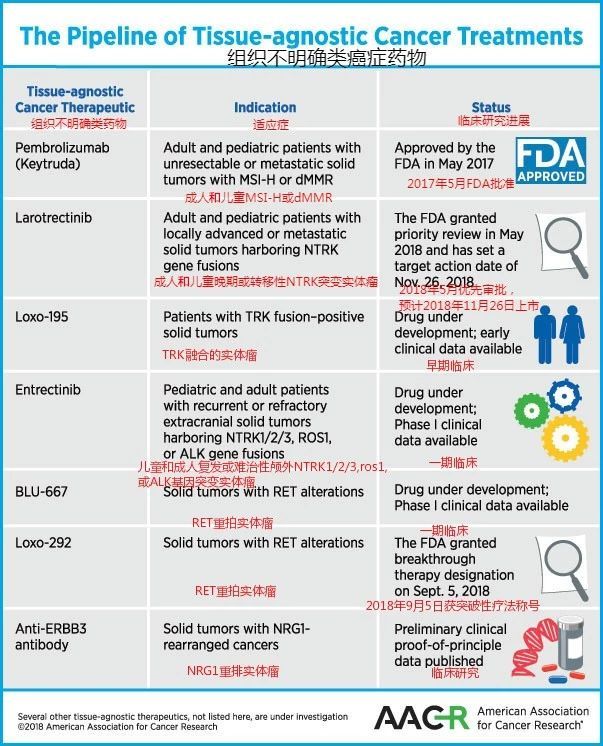
八、类似的不区分癌症种类的广谱抗癌药还有哪些?
以下是美国癌症研究协会列出的除keytruda外,6种值得期待的不区分组织来源的重磅抗癌药物及研发进展,详情点击:美国癌症研究协会公布六种值得期待的癌症重磅新药!
梦想终将照进现实!
Larotrectinib的批准反映了使用生物标志物指导药物研发和靶向递送药物领域的重大进展。越来越多的医生将有能力让合适的患者在正确的时间获得匹配药物的治疗!
我们处在一个充满奇迹的时代,快速发展科技给人类带来了新的希望。曾经,癌症是不治之症。但随着抗癌手段的不断更新,尤其分子靶向药物等新一代的治疗方法的出现,人类全面战胜癌症的那天不再遥不可及。,规范合理的用药,把癌症变成可以控制的慢性病,是医生和科学家共同的目标。让我们一起见证这一天的来临!


